Chaque année, le virus de l’hépatite B est responsable d’environ un million de morts à l’échelle mondiale. De plus, un peu moins de 300 millions de personnes vivent en étant chroniquement infectées par le virus (Razavi-Shearer, 2023). Sans traitement antiviraux, entre 15 et 40% des personnes vivant avec une hépatite B chronique voient leur santé se dégrader, en progressant notammant vers des complications telles que cirrhose (inflammation chronique menant à des dommages hépatiques), défaillance hépatique (incapacité du foie à fonctionner), ou cancer (notamment des cancers hépato-cellulaires, ou CHC) (McMahon, 2009). Il existe aujourd’hui tout un arsenal thérapeutique (vaccins, traitements antiviraux, etc.) efficace et sûr pour prévenir l’infection tout comme la progression des formes chroniques vers des formes plus graves. Cependant, de nombreux obstacles se dressent sur la route de l’accès à toutes et tous à ces traitements, et sur celle de l’identification des personnes éligibles aux traitements antiviraux. Le premier travail que j’ai réalisé pendant et après ma formation en épidémiologie a été de participer au développement d’un outil d’aide à la décision à destination des professionnel·les de santé exerçant en Afrique sub-Saharienne dans des contextes d’accès aux ressources (humaines comme matérielles) limitées. Dans un petit dispensaire éloigné des grandes villes, et parfois même dans un hôpital de ville, il peut être compliqué d’orienter une personne vers un endroit qui pourra réaliser des examens cliniques et/ou biologiques nécessaires à sa bonne prise en charge médicale. Le résultat de ces travaux de recherche ont fait l’objet d’une publication dans The Lancet - Gastroenterology and Hepatology que vous pouvez lire ici, accompagnée d’une version vulgarisée en français dans les Supplementary Materials, ici. Dans ce billet, je souhaite approfondir avec vous quelques éléments de context, ainsi qu’un ou deux points de méthodes, avec pour objectif que chacun puisse avoir un apperçu de comment des modèles statistiques peuvent être employés pour guider la préatique médicale. Bonne lecture !
Introduction
Le virus de l’hépatite B (VHB) est un virus qui cible (pour s’y répliquer) les cellules du foie. Il se transmet par les fluides corporelles, ce qui se produit par au travers de rapport sexuels, de contacts peu hygiéniques entre enfants (morve, vomisures, etc.), partage de seringues, transmission de la mère à l’enfant (surtout pendant ou à proximité de l’accouchement), dans des proportions qui dépendent des pays et du contexte. Souvent, l’infection passe sans causer de dommages, mais elle peut parfois s’avérer être grave dans une forme aigüe, passagère, qui est mortelle dans environ 1% des cas. Egalement, l’infection peut se chroniciser, c’est à dire que le corps ne parvient pas à se défaire totalement du virus, qui continue de se répliquer dans le foie de son hôte, en général pour toute la durée de sa vie. Cela se produit quelques fois chez l’adulte, mais est presque systématiquement le cas chez les nouveaux-nés. Chez ces personnes, l’infection peut rester stable à un faible niveau, et ne pas se traduire par une détérioration notable de l’état de santé. Chez certaines d’entre elles, en revanche, leur foie subira des dommages plus moins prononcés, et plus ou moins rapidement au cours de leur vie.
Deux objectifs sont donc apparents. Premièrement, il faut identifier les personnes dont l’état de santé se dégrade, voire identifier leur profil avant toute dégradation. Egalement, il faut épuiser le réservoir de personnes susceptibles d’être infectées en vaccinant toute personne exposée à des risques d’infection. En amont de tout cela, il faut évidemment dépister un maximum de personnes infectées par le VHB, à quelque stade que ce soit, pour qu’elle soient au courant de leur statut infectieux, et prises en charge correctement.
Comme dit plus haut, ces deux objectifs sont, en théorie, à portée de bras. Tout du moins, nous avons dans notre arsenal thérapeutique et des test diagnostiques fiables, et vaccins efficaces et sûrs, et des recommendations reconnues efficaces pour identifier les personnes infectées dont la santé se dégrade ou à risque de voir leur santé se dégrader, et des traitments antiviraux efficaces et sûrs à prescrire à ces personnes. Sur le papier, l’hépatite B est une maladie dont les heures sont comptées, mais dans les faits, on patine… alors pourquoi ?
Défis et objectifs
Dans de nombreux pays, l’hépatite B n’est pas ou plus un problème de santé publique. En Europe du Nord-Ouest, les enfants ne sont généralement pas vacciné à la naissance, car on estime que leurs chances d’être exposés au virus sont proches de zéro. La plupart des (rares) nouvelles contaminations y surviennent chez l’adulte qui, comme nous venons de le dire, a peu de chances de voir l’infection se chroniciser et évoluer vers des formes graves ou mortelles. De plus, les outils permettant de vérifier si cet adulte a un profil à risque sont présents, rarement loins, et souvent au moins partiellement pris en charge dans leur coût par l’état, la collectivité, une assurance. Or, dans certaines région du monde, c’est tout l’inverse : les infections sont surtout le fait d’une transmission de la mère à l’enfant, les services médicaux sont loins du lieu d’habitation d’une grande partie de la population, tous les services ne sont pas accessibles, et sont à la charge de la personne infectée. Malheureusement, c’est le cas dans une zone de forte endémicité (de forte présence du virus), l’Afrique, et notamment l’Afrique sub-Saharienne.
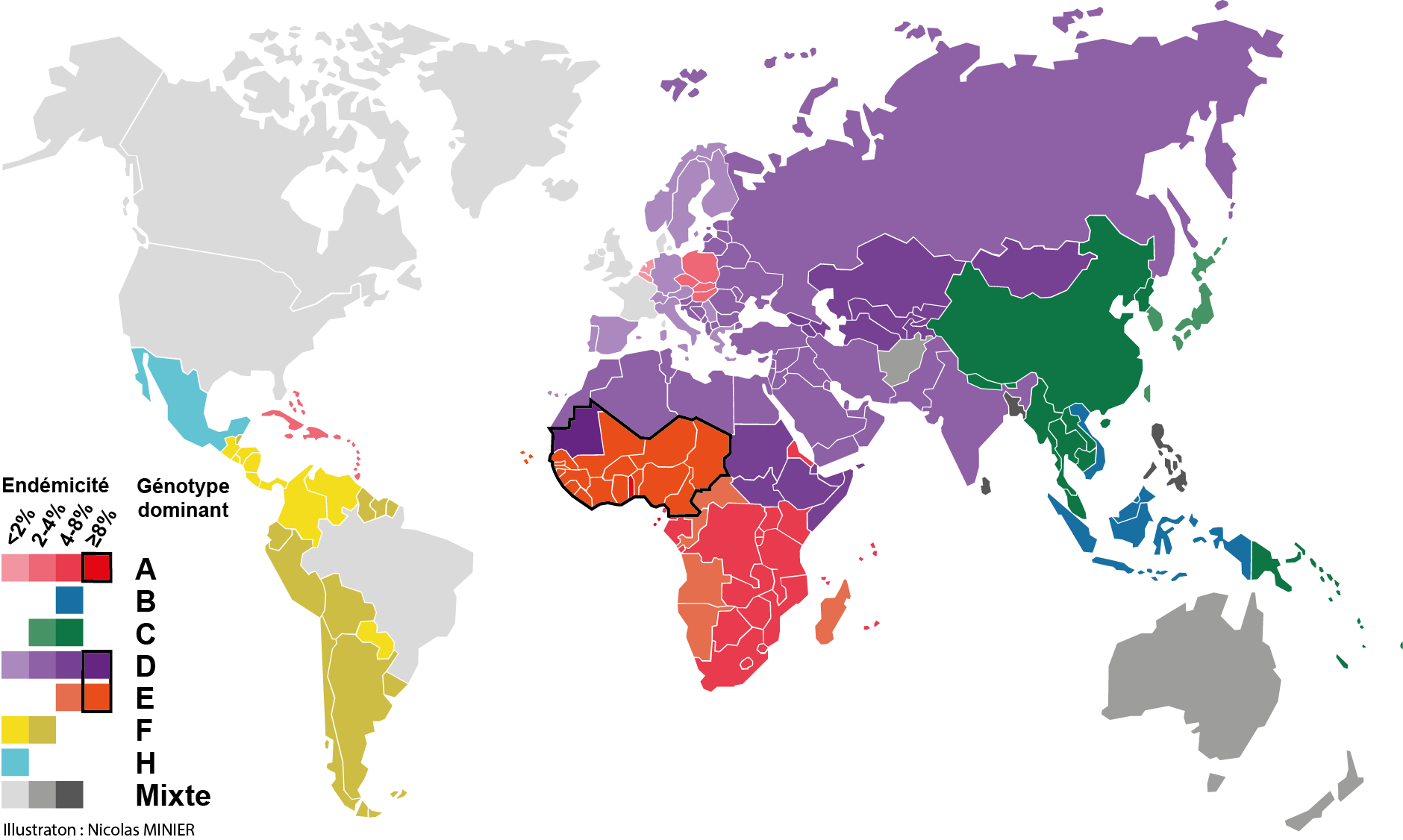
Carte de l’endémicité du virus de l’hépatite B (i.e. sa présence en proportion de personnes infectées). La Chine et l’Asie centrale, l’Asie du Sud-Est, et l’Afrique sub-Saharienne apparaissent comme les régions les plus touchées par le virus.
Entendons-nous bien : tous les pays africains disposent d’hôpitaux et d’équipement de pointes, ainsi que de personnel qualifié et hautement compétent. Le problème est en partie du fait que le VHB place la barre très haut pour réussir à l’éliminer comme menace pour la santé publique. Lorsqu’une majorité des transmissions se font de la mère à l’enfant, il est impératif de vacciner au plus tôt les enfants nés d’une mère vivant avec le virus, si possible dans les premières 24h suivant la naissance. Disposer de vaccins et caler un rendez-vous dans les jours ou semaines qui suivent une naissance est une chose, être disponible partout sur le territoire de pays parfois grands comme 3 ou 4 fois la france, et arriver au chevet d’une naissance dans les 24h quand celle-ci s’est déroulée dans une ville ou un village au bout d’une piste dans le bush ou la forêt, c’en est une autre ! De plus, les recommandations qui font référence pour identifier les personnes à risque de voir leur santé se dégrader exigent le recours (en plus de divers tests biologiques) à une mesure de l’élasticité hépatique (qui peut s’obtenir au moyen d’un appareil d’élastographie) ou à une biospie, ainsi qu’à une mesure précise de la charge virale (comprenez le nombre de virus retrouvés dans un volume de sang). Ce n’est pas quelque chose que vous trouverez à tous les coins de rues. Dans de nombreux pays africains, si c’est outils et le personnel compétent se trouvent, il est en général restreint aux grands hôpitaux, dans quelques villes du pays. Lorsque le pays est immense, une partie conséquente de la population se retrouve à payer, en plus des soins, le transport et le temps de travail perdu.
En 2016, l’OMS annonçait un branle-bas de combat destiné à mobiliser chercheurs, fondations, états, tout le monde, avec pour objectif de mettre un terme à la “menance pour la santé publique” que fait peser le VHB. Objectif : d’ici à 2030, un nombre de nouvelles infections annuelles divisé par 10, et par 3 pour la mortalité OMS. La vaccination des nouveaux-nés de mère vivant avec le virus est une des priorité, et concerne surtout l’atteinte du premier objectif de l’OMS, en faisant baisser le nombre de nouvelles infections (et donc de morts, mais pas d’ici 2030, pas dans les proportions de l’objectif fixé par l’OMS). Le second objectif, en revanche, dépendra surtout du nombre de personnes à risques qui sont effectivement sous traitement dès aujourd’hui, or on estimait qu’en 2019 seul 2% des personnes vivant avec le virus étaient sous traitment, quand environ 15 à 20% d’entre elles sont à risque. Pour atteindre l’objectif de réduction des formes graves et de la mortalité associée au virus, il faudrait vraissemblablement traiter 10 à 15% des personnes vivant avec le virus (et encore ! ce serait partir du principe que notre identification des personnes à risque est parfaite, dans la réalité, il faudra aller au dela). En Afrique sub-Saharienne, une des zones où le virus est le plus présent (avec notamment la Chine et l’Asie du Sud-Est), c’est moins de 0,1% des personnes vivant avec le VHB qui sont sous traitement, notamment pour les raisons discutées plus haut. Nous somme à mi-chemin de l’échéance de 2030, et dire que le compte n’y est pas serait un euphémisme. Il est urgent de rendre accessible des outils fiables d’identification des personnes à risque, et ce même en dehors des grands centres hospitaliers.
Consortium HEPSANET
Dans l’objectif de participer aux efforts de lutte contre le VHB, un réseau collaboratif s’est constitué autour de cliniciens et cliniciennes menant également des activités de recherche : le Hepatitis B in Africa Collaborative Network, ou “HEPSANET”. Ce réseau réunit de nombreuses personnes travaillant dans des hôpitaux et centres de recherche en Afrique sub-Saharienne, ayant à coeur de faire avancer le combat contre l’hépatite B (NB : certaines personnes qui travaillaient en Afrique sub-Saharienne travaillent aujourd’hui partiellement ou à temps plein en Europe, ce qui explique la participation aux publications de quelques centres de recherches de France, de Norvège, et du Royaume-Uni, notamment). Ces chercheurs et chercheuses ont rapidement mis en commun les cohortes de patient·es qu’ils et elles suivaient, constituant ainsi une large méta-cohorte, la plus large qui existe à ce jour pour décrire avec ce niveau de détail biologique/médical des personnes vivant avec le VHB en Afrique sub-Saharienne.
Constatant la diffculté de rendre accessible les outils de référence de l’évaluation des personnes vivant avec le VHB (biospie, élastographie) en dehors des grands centres hospitaliers, le consortium HEPSANET s’est donné pour objectif d’identifier, parmi les outils cliniques et biologiques déjà accessibles dans des centres périphériques, une combinaison de quelques tests permettant d’identifier de manière aussi fiable que possible les personnes pour lesquelles la mise sous traitement est recommandée. En réalité, une première tentative avait déjà été publiée en 2018 par un membre du consortium qui travaillait alors en Gambie, mais ils s’était avéré qu’un des outils requis par le test développé n’était aussi accessible dans le reste de l’Afrique sub-Saharienne que l’auteur principal de l’étude ne le supposait. Dans les fait, le test proposé, bien qu’intéressant, n’a pas été très suivi sur le terrain.
En 2022, le consortium remet l’ouvrage sur le métier. A ce moment là, je terminais ma formation en épidémiolige, et passais quelques mois à l’Institut Pasteur (Paris) dans l’Unité d’Epidémiologie des Maladies Emergentes, à travailler avec Yūsuke Shimakawa, auteur de la première tentative. Nous avons cette fois accès à la base de données collaborative du consortium, riche de plusieurs milliers de participant·es venant de 13 pays d’Afrique sub-Saharienne. Et on se met au travail. Pour assurer le coup, je commence par distribuer à tous les membres du consortium un questionnaire demandant des détails sur la disponibilité effective sur le terrain d’un certain nombre de tests biologiques, et la capacité des équipes soignantes à détecter quelques signes cliniques importants, et ce à différents niveaux de structures sanitaires.
Prédire l’éligibilité d’une personne
Comment donc prédire si une personne est à risque de voir son état de santé se dégrader (et devrait donc se voir conseiller d’initier un traitement antiviral) ?
Dans l’idéal, on suivrait pendant plusieurs années l’état de santé personnes vivant avec le VHB, et on attendrait de voir quelles personnes développent cancer, cirrhose, défaillance hépatique. On pourrait alors comparer les personnes dont l’état de santé est resté stable à celles dont l’état de santé s’est dégradé, et voir si dès la première année du suivi il était possible d’identifier des indices qui pouvaient déjà prédire ce qui allait arriver par la suite. Malheureusement, un tel travail n’existe pas en Afrique sub-Saharienne, ou du moins pas encore puisque des membres du consortium HEPSANET viennent justement d’obtenir des fincancement pour pouvoir l’entreprendre. En attendant que ces travaux portent leurs fruits, il nous faut faire autrement. En l’occurrence, plutôt que de prédire la survenue de complications, nous nous sommes attachés à prédire l’éligibilité aux traitements antiviraux telle que préconisée par les recommandations de l’European Association dor the Study of the Liver (EASL), qui font référence en la matière. Nous considèrerons que les recommandations EASL (datant de 2017) sont efficaces pour identifier les personnes à risque de voir leur santé se dégrader, ou dont l’état de santé s’est déjà dégradé.
Mais cela ne réponds pas entièrement à la question. Une fois que l’on a acté (par exemple) que les personnes éligibles ont un taux de tel ou tel marqueur sanguin plus élevé que les personnes non-éligibles, comment décider d’un seuil à partir duquel la probabilité que cette personne soit éligible sont telles qu’on va lui recommander une mise sous traitement ? Comment faire également lorsque plusieurs paramètres prédicteurs doivent être prise en compte ? Pour cela, nous nous sommes appuyé sur des modèles de “régression”, mettant en équation une chose à prédire (on utilisera volontier le mot anglais outcome, désignant l’issue, la résultante, qui est dans notre cas l’éligibilité au traitement) avec les valeurs prises par un certain nombre de prédicteurs. Vous trouverez dans le graphique ci-dessous plusieurs exemples de modèles de régression qui peuvent être univariés (c’est à dire ne faisant dépendre l’outcome que d’une variable prédictrice) ou multivariés, et faire intervenir différentes relations possible entre prédicteurs et outcome. Notamment, lorsque l’outcome est binaire, on utilisera parfois (lorsque les conditions s’y prêtent) un modèle logistique, dans lequel la prédiction transissionne d’une modalité à une autre. Dans notre cas, c’est effectivement un modèle de régression logistque multivarié qui a été employé, faisant transissionner notre prédiction d’un état (non-éligible aux traitement antiviraux) à un autre état (éligible), en fonction de plusieurs paramètres.
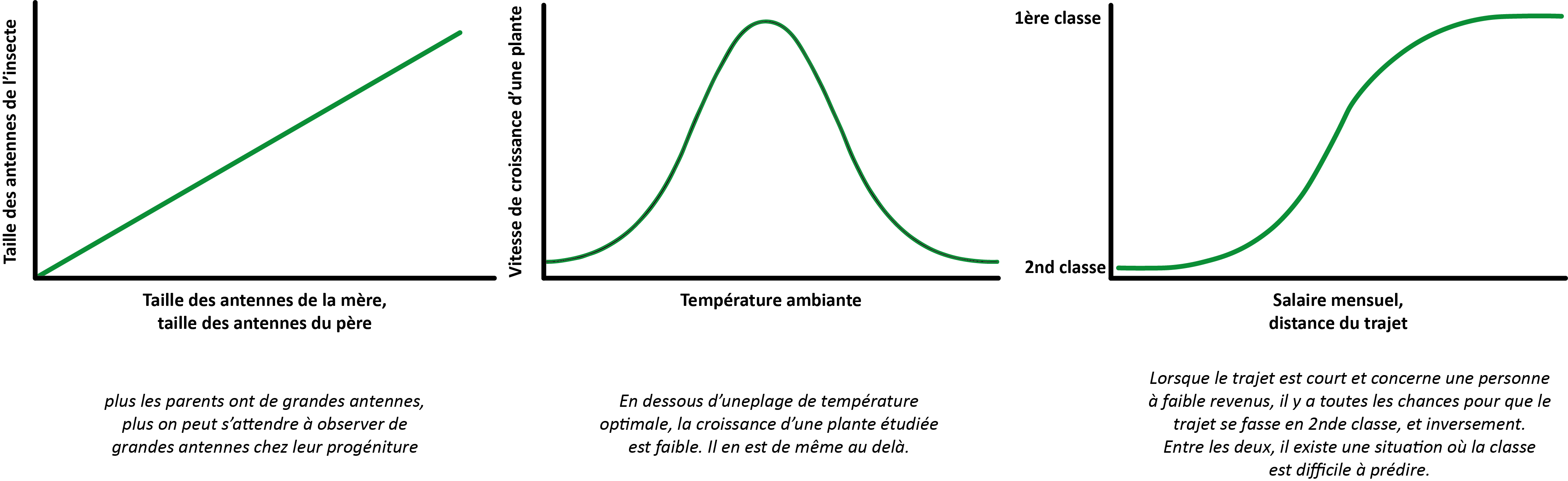
Différents modèles de régression. (A) Modèle de régression linéaire multivarié cherchant à prédire la taille des antennes d’un insecte à partir de la taille des antennes de ses parents biologiques. (B) Modèle de régression univarié suivant une courbe gaussienne, cherchant à prédire la vitesse de pousse d’une plante en fonction de la seule température ambiante. (C) Modèle de régression logistique multivarié, cherchant à prédire la classe dans laquelle voyage une personne en fonction de son salaire et de la distance du trajet.
Reste maintenant à savoir quels prédicteurs utiliser. Une façon de faire est de procéder par étape, en incluant un à un les prédicteurs les plus fortement associés avec l’outcome (ou excluant un à un ceux les moins corrélés avec celui-ci). L’opération est répétée jusqu’à ce que l’ajout de nouveaux prédicteurs ne change rien à la pertinence du modèle (où jusqu’à ce que le retrait d’un prédicteur ne fasse brusquement chuter cette pertinence, dont je ne détaillerai pas ici comment elle est objectivée). Dans notre cas, en plus de cette sélection par itération, nous avons la contrainte de ne pas considérer tous les prédicteurs à notre disposition (diagnostics cliniques, dosages sanguins, test antigéniques, etc.) mais uniquement ceux dont on estime qu’ils sont relativement accessibles même en dehors des grands hôpitaux. Cette disponibilité, nous l’avons évaluée grâce au questionnaire distribué aux praticien·nes du consortium, à qui nous avons demandé de décrire la situation dans leurs pays respectifs. De plus, afin de produire un test qui soit le plus facile à mettre en place sur le terrain, nous nous sommes limité à l’inclusion de trois prédicteurs, pas plus, pour un test destiné à être déployé dans le “Tier 2” dans la terminologie de l’OMS, désignant les petits hôpitaux, dont dépend une bonne part de la population.
Pris en considération tout ce que nous venons de dire, nous aboutissons au modèle statistique présenté ci-dessous pour calculer la probabilité d’être éligible aux traitements antiviraux selon les recommandations EASL 2017.
$$ P(éligibile) = \frac{1}{1+e^{-\big[-0.9462 + 1.5265 \times ln(ALT) + 1.1912 \times ln(AST) - 1.9656 \times ln(plaquettes)\big]}} $$
Ce modèle fait intervenir deux mesures d’activité enzymatique (enzymes alanine aminotransférase “ALT” et aspartate aminotransférase “AST”), ainsi que la numération plaquettaire (le nombre de plaquettes retrouvées par volume de sang). Ce n’est pas l’objet de ce billet que de détailler le rôle biologique de ces enzymes et des plaquettes. Sachez simplement que des mesures élevées d’ALT et AST, tout comme une baisse de la numération plaquettaire, sont des signes biologiques fréquemment retrouvés lorsque le fonctionnement du foie est altéré, voire défaillant. Les retrouver ici n’est donc aucunement une surprise. Vous noterez que, plutôt que d’utiliser la valeur brute de ces paramètres biologiques, nous utilisons leur logarithme naturel. En pratique, cela signifie que l’on considère qu’il est moins grave de passer 100 à 110 (dans l’unité de mesure d’un des prédicteurs) que de 10 à 20. Utiliser la valeur brute y verrait le même gain de 10 unités, quand la transformation logarithmique raisonne plutôt en multiples (passer de 10 à 20 correspond à un multiplication par deux de la valeur, quand passer de 100 à 110 n’est qu’une hausse toute relative quand on considère que l’on est parti de 100). Pour alléger l’équation, cachons la notation du logarithme, et disons simplement que le risque encouru par une personne dépend de :
$$ 1.5265 \times ALT + 1.1912 \times AST - 1.9656 \times plaquettes $$
Le reste de l’équation n’est que la transformation de ce risque en une courbe en forme de “S” correctement positionnée. Ce que nous dit cette équation, c’est que gagner 1 unité dans la mesure ALT est 1,5265/1,1912 = 1,28 fois plus “grave” que de progresser d'1 unité dans la mesure AST. Dit autrement, chaque gain en ALT nous fait progresser vers la droite du graphique ci-dessous environ 1,28 fois plus vite qu’un même gain dans la mesure AST. Le coefficient négatif devant “plaquettes” indique que c’est au contraire une baisse de la numération plaquettaire qui nous fait progresser vers la droite, c’est à dire vers de fortes chances d’être éligible au traitement.
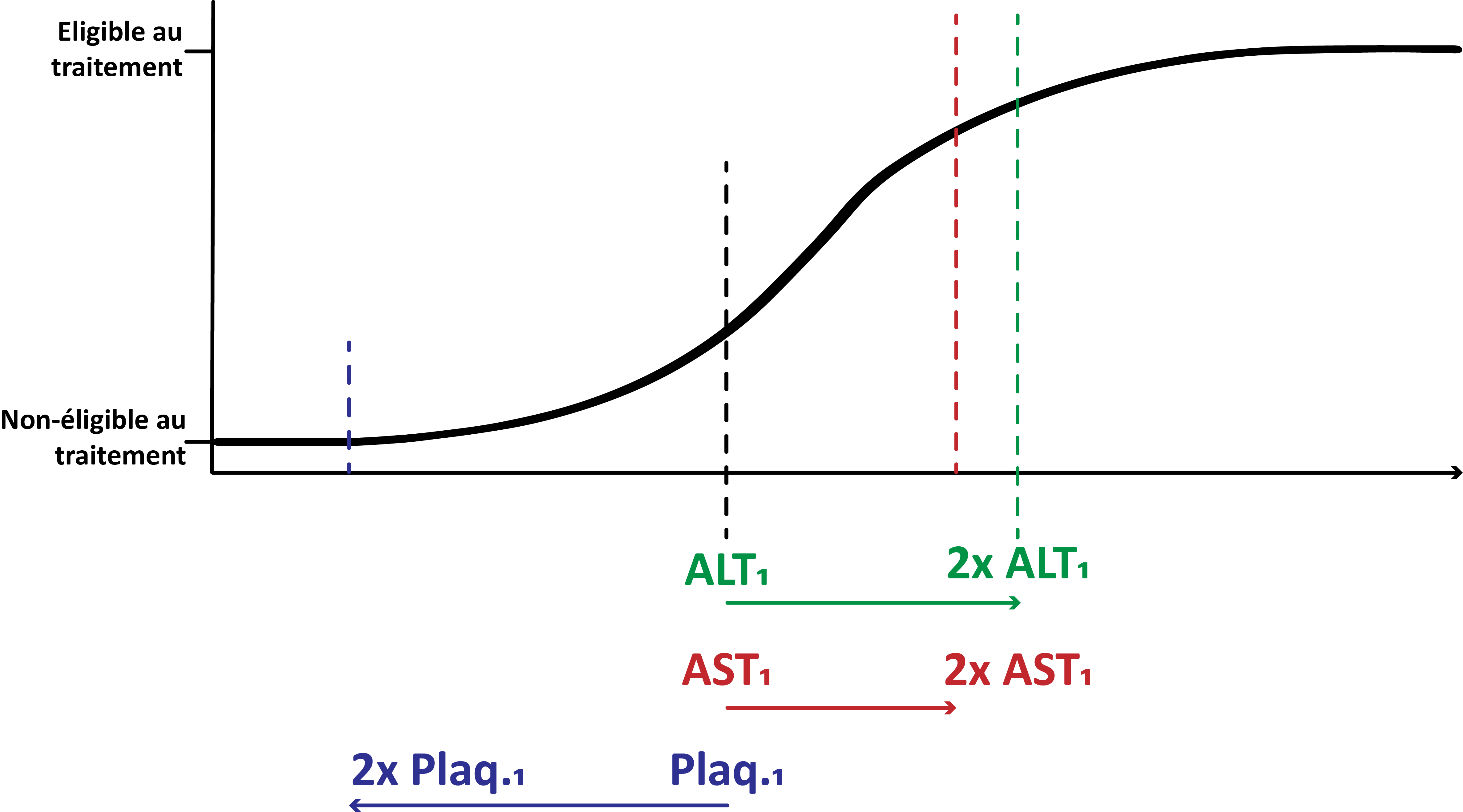
Coefficients et distances augmenter la valeur de la mesure ALT fait progresser vers de plus grandes probabilités d’être éligible. Il en est de même pour les valeurs AST, mais dans une moindre mesure, le coefficient associé à AST (1,1912) étant plus faible que celui associé à ALT (1,5265). Au contraire, la numération plaquettaire étant associée à un coefficient fortement négatif, augmenter la numération plaquettaire fait rapidement progresser vers de plus faibles probabilité d’être éligible.
D’un modèle statistique à un score simplifié
L’équation donnée plus haut dans sa forme brute est trop abstraite pour être donnée telle quelle en recommandation aux praticien·nes. Il s’agit maintenant de la transformer en un score simplifié, plus pratique d’usage. Pour ce faire, nous catégorisons les prédicteurs, définissons une catégorie de base, et attribuons à toute personne se trouvant dans une catégorie une valeur de référence (ici, la médiane). Dans notre cas, nous souhaitons un score le plus simple possible, et avons opté pour 3 catégories par prédicteurs. Ainsi, on considère que les personnes ayant moins de 40 UI/L (unité internationale par litre) dans leur mesure ALT ont tous 21 UI/L, que ceux qui ont entre 40 et 80 UI/L ont 48 UI/L et se trouvent donc à \([ln(48)-ln(21)] \times 1,5265 = 1,26 \) unités de distance de la catégorie de référence, et que les personnes avec plus de 80 UI/L ont 125 UI/L et se trouvent donc à \([ln(125)-ln(21)] \times 1,5265 = 2,72 \) unités de distance de la catégorie de référence. En suivant la même logique pour AST et numération plaquettaire, puis en normalisant ces distances, nous aboutissons au tableau présenté en appendice 6 de l’article.
Ces “distances à la référence” peuvent être arrondies à l’entier le plus proche, afin d’obtenir des “points”. Chacun de ces points représente une distance parcourrue vers la droite de nos précédents graphique d’environ la même distance, quelque soit la variable prédictrice qui a marqué ce point. Une représentation graphique de la catégorisation et de la transformation en score simplifié peut être trouvé ci-dessous.
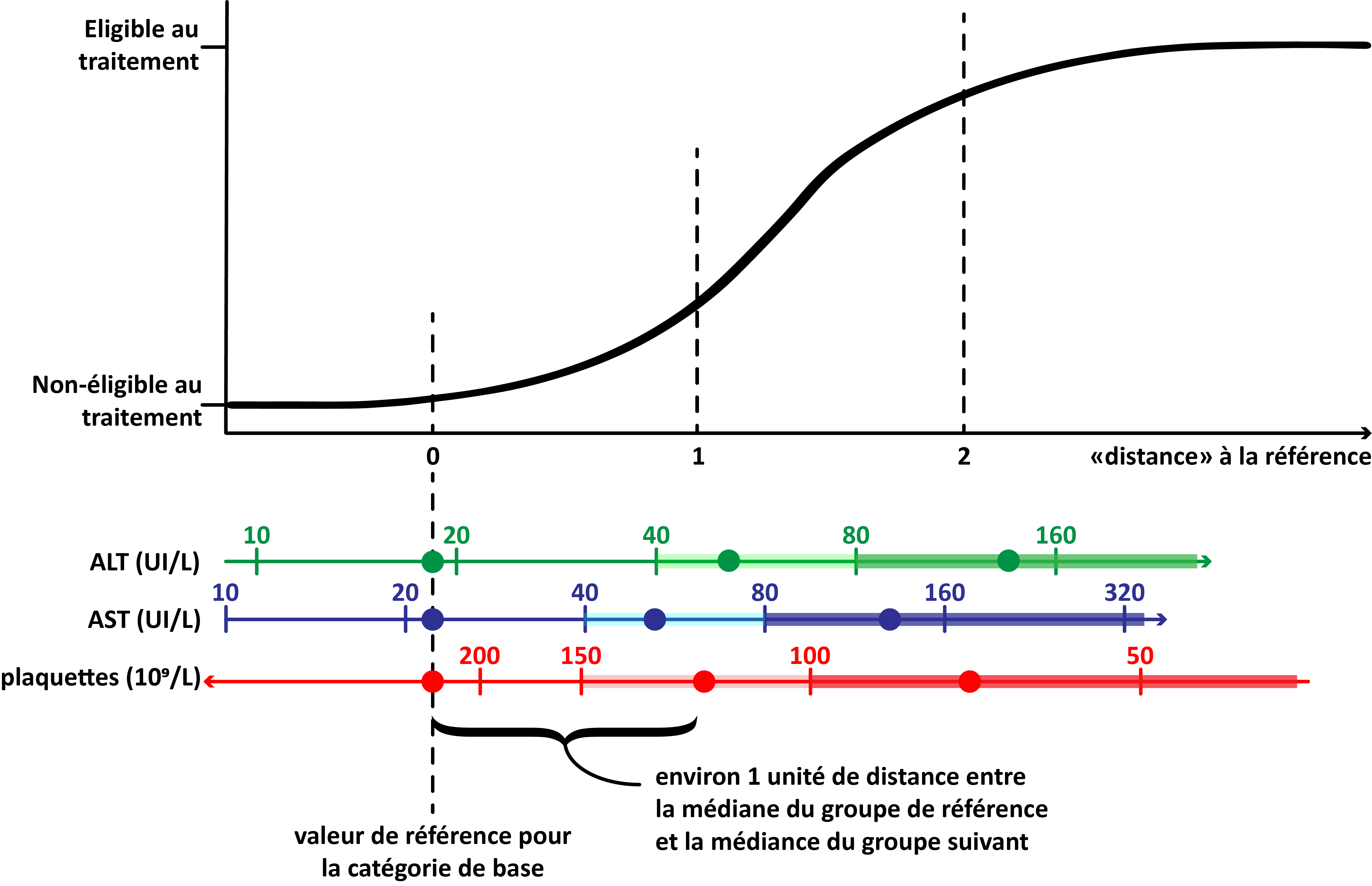
Simplification du modèle en régression logistique multivarié. Après avoir catégorisé les variables et identifié une valeur de référence pour chaque variable (dans notre cas, la médiane, indiquée ici par un point), on peut considérer pour chaque participant à l’étude sa “distance à la référence” pour chaque variable. Cette distance, normalisée puis arrondie à l’entier le plus proche, devient un “point” dans notre score simplifié. N.B. : le graphique présenté ici n’est pas à l’échelle et n’est à considérer qu’à titre d’exemplification de la méthode.
Une fois tout ceci acté, il nous reste à établir à partir de combien de points doit-on considérer qu’il y a réalisation de l’outcome ? Sitôt que la probabilité de l’outcome dépasse 50% ? Pas forcément. En épidémiologie, lorsqu’il s’agit de diagnostiquer un état (pourquoi pas une maladie, mais ici une éligibilité), on se réfère principalement à deux mesures de performance d’un test diagnostic : la sensibilité (dans notre cas, le pourcentage de personnes éligibles que notre test détectera comme telles) et la spécificité (le pourcentage de personnes non-éligibles que notre test détectera comme telles). Selon les cas de figures, on peut être amené à favoriser l’une ou l’autre de ces métriques. Par exemple, lors du diagnostic d’une maladie grave dont le traitement est sans grande conséquence s’il est donné à tort à une personne non malade, on est prêt à favoriser la sensibilité du test, quitte à sacrifier sa spécificité s’il le faut. Des personnes non-malades seront traitées à tort, mais les personnes effectivement malades seront toutes ou presques traitées et sauvées. Dans certains cas, on fera l’arbitrage inverse, et l’on préfèrera ne diagnostiquer que les personnes pour lesquelles on a une absolue certitude sur le diagnostique, quitte à ne pas identifier toutes les personnes mértiant le diagnostic. Ces cas sont plus rares dans le domaine médical, et l’on prend souvent l’exemple des spams comme illustration. Mieux vaut laisser quelques emails méritant le diagnostic “spam” dans la boîte au lettre, que de chercher à tous les diagnostiquer correctement, si cela implique de basculer un certain nombre d’emails dans la catégorie spam. Le désagrément de devoir de temps en temps supprimer un spam manuellement est jugé inférieur à celui d’être passé à côté d’un email important.
Dans notre cas, nous avons choisi de nous reposer sur la somme de la sensibilité et de la spécificité (parfois appelée “statistique J de Youden”) pour déterminer quel seuil a la meilleur performance diagnostique. En pratique, cela signifie que x% de mauvais diagnostic parmi les personnes éligibles est aussi pénalisé que x% de mauvais diagnostics parmi les personnes non-éligibles. Comme l’on a plus de personnes non-éligible que de personne éligibles, cela implique dans notre cas que l’on accepte de proposer le traitement à un certain nombre de personnes non-éligibles, afin de s’assurer qu’un maximum de personnes éligibles soient identifiées. C’est tout à fait acceptable dans notre cas dans la mesure où les traitements antiviraux contre le VHB sont biens tolérés et responsables de peu d’effets indésirables. (Comme alternative à la situation actuelle, certains proposent même de traiter toute personne vivant avec le virus ! Cela simplifierait radicalement l’approche, effectivement, mais n’est pas jugé souhaitable par tous, compte tenu du fait que 300 millions de personnes seraient alors en compétition pour accéder à une prescription à vie, posant un tout autre problème logistique et économique)
Performance de l’algorithme décisionnel
Nous n’en avons pas parlé ici, mais le score simplifié que nous développons a vocation à s’insérer dans un algorithme décisionnel qui inclue également de se renseigner sur les antécédents familiaux de cirrhose et de cancers hépatocellulaires (CHC), et d’évaluer si la personne vivant avec le VHB présente des signes cliniques d’une décompensation cirrhotique (pour le dire simplement, le fonctionnement du foie est tellement altéré que des signes physiques apparaissent, tels que jaunissement de la peau et des yeux, gonflement du ventre, etc.). Pour ces personnes, nul besoin d’avoir recours au score simplifié : elles sont d’office considérées éligibles. Le score simplifié ne s’applique donc qu’aux personnes sans signes cliniques de décompensation ni antécédent de cirrhose et/ou CHC dans leur famille proche. Tout ceci pris en considération, vous trouverez ci-dessous l’algorithme décisionnel destiné aux petits hôpitaux. Pour les personnes ayant recours au score simplifié, elles sont considérées éligibles si elles scorent au moins 2 points.

La performance de cet algorithme, mesurée chez d’autres personnes que celles qui ont servi à produire le modèle de régression logistique, est objectivée par une sensibilité de 78% et une spécificité de 87%. En supposant que 15% de la population vivant avec le VHB est éligible, cela signifie que sur 100 personnes vivant avec le VHB, nous identifierons comme éligible autour de 11-12 personnes parmi les 15 qui sont éligibles, et traiterons alors que ce n’était pas forcément nécessaire environ 11 personnes parmi les 85 qui sont non-éligibles. Ce n’est pas parfait, mais rappelons que l’on part d’une situation où 0,2% des personnes vivant avec le VHB sont sous traitement en Afrique sub-Saharienne. Si nous comparons notre performance à celle d’autres alternatives aux recommandations EASL qui ont été développées pour être déployer dans des contextes où les recommandations EASL ne peuvent l’être, nous observons deux choses. Premièrement, les alternatives développées (score TREAT-B de 2018, score HePAA de 2023, recommandations de l’OMS de 2015) ne peuvent pas être déployées à l’échelle des petits hôpitaux de “Tier 2”, du fait de l’emploi de tests qui sont en général trouvés uniquement dans de plus grands hôpitaux de niveau régional (“Tier 3” dans la nomenclature OMS) ou national (“Tier 4”). Deuxièmement, la performance des recommandations OMS sont inférieures à celles du test que nous avons développé : les recommandations en questions ne détectent que 38% des personnes éligibles. Les performances des scores TREAT-B et HePAA doivent être comparées avec celle d’un test développé avec les outils diagnostiques disponibles dans les hôpitaux de Tier 3 (d’envergure régionale). Sans entrer dans les détails, nous avons également développé un tel test, qui inclu (en plus des prédicteurs précédents) un test antigénique, et obtient des performances tout à fait comparables à celles des scores TREAT-B et HePAA. À ce niveau de structure hospitalière, nous n’apportons pas d’amélioration diagnostique, mais les praticien·nes pourraient tout de même apprécier de ne pas utiliser de scores radicalement différent selon l’hôpital où ils se trouvent.
Conclusion
Ces travaux montrent plusieurs choses. Premièrement, un état des lieux est dressé concernant la disponibilité de plusieurs tests biologiques et capacité à poser certains diagnostics cliniques d’importance. Cet état des lieux est certes assez grossier, mais reste très informatif, du fait du peu d’alternatives existantes sur lesquelles se baser. Surtout, il met en exergue la faible disponibilité sur le terrain de plusieurs tests pourtant requis par les recommandations sensées s’adresser aux contextes où les recommandations de référence sont inapplicables. Deuxièmement, ces travaux montrent qu’une combinaison de 2 tests (les transaminases ALT et AST étant généralement mesurées ensemble) permet d’identifier une part importante des personnes éligibles aux traitements antiviraux.
Cette étude a plusieurs forces notables. D’une part, elle s’appuie sur la plus large cohorte de personnes vivant avec le VHB en Afrique sub-Saharienne, garantissant une certaine puissance statistique. De plus, de s’appuyer sur les résultats à un questionnaire transmis aux praticien·nes de plusieurs pays nous donne une certaine confiance dans l’affirmation que les tests sur lesquels le score HEPSANET s’appuie devraient être accessibles dans de nombreux hôpitaux de petite taille. Ajoutons à cela que, même dans le cas où ils ne seraient pas aujourd’hui accessibles dans certains hôpitaux, l’effort à fournir pour y implémenter le socre HEPSANET est bien inférieur à celui qu’il faudrait fournir pour équiper les hôpitaux en questions avec les outils requis par les recommandations de référence.
Il faut cependant noter quelques points qui invite à la mesure, que vous trouverez dans la publication originale. Pour prendre un exemple, la mesure de la performance de l’algorithme décisionnel se base sur les recommandations EASL 2017 comme référence. Ce choix est fait “faute de mieux” : l’idéal aurait été, comme dit plus haut, de se baser sur l’évolution réelle de l’état de santé des personnes. Ce travail venant tout juste de commencer, nous devons pour l’instant faire l’hypothèse que les recommandations EASL 2017 prédisent avec une grande efficacité le risque de voir l’état de santé d’une personne se dégrader. Une fois les études longitidinales (suivant des personnes dans le temps) menées, il sera sans doute nécessaire d’amender le score HEPSANET pour l’améliorer.
Malgré cela, le score HEPSANET reste sans doute le mieux qu’il soit possible de faire sur le terrain à court terme, et le consortium HEPSANET nourrit de grands espoirs pour ce test. L’avenir nous dira si le personnel soigant se l’approprie, et quel impact son usage aura sur la mortalité liée au virus de l’hépatite B en Afrique sub-Saharienne.